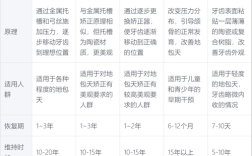
正畸新技术申报是推动口腔正畸领域创新发展、规范技术应用、保障患者安全的关键环节,随着数字化、个性化正畸技术的快速迭代,系统化、规范化的申报流程已成为新技术从研发走向临床应用的必经之路,正畸新技术的申报不仅涉及技术本身的创新性和有效性验证,还需兼顾伦理合规、临床需求匹配及长期安全性评估,其核心目标是确保每一项进入临床的新技术均具备科学依据、可重复性和明确的应用价值,从而推动行业整体进步,为患者提供更优质、安全的正畸治疗选择。
正畸新技术申报的必要性首先源于医疗监管的刚性要求,根据《医疗器械监督管理条例》及国家药品监督管理局(NMPA)相关规定,正畸领域涉及的新技术、新材料(如隐形矫治器、自锁托槽、骨钉技术等)若属于医疗器械范畴,需按照第三类医疗器械进行注册申报;若为新型诊疗方法,则需通过医疗机构临床技术准入审批,未获批准的技术不得在临床推广应用,这是保障患者权益、避免技术滥用的重要防线,申报过程是对技术成熟度的系统性检验,通过申报,研发单位需全面梳理技术原理、设计思路、创新点,并通过严格的实验研究和临床试验验证其有效性与安全性,这一过程能有效筛选掉不成熟、风险高的技术,避免盲目应用对患者造成伤害,申报也是促进技术标准化和产业化的桥梁,通过申报材料中的技术参数、操作规范、质量控制要求等,可推动形成行业共识,为后续生产、使用、监管提供统一依据,加速技术从实验室成果向临床产品的转化。

正畸新技术申报的流程通常分为前期准备、资料撰写、提交受理、技术审评、行政审批及后续监管六个阶段,各环节环环相扣,需申报方严格把控,前期准备阶段,申报单位需明确技术分类(如医疗器械、诊疗技术等),确定申报路径(如创新医疗器械特别审批、常规审批等),并组建由研发人员、临床专家、法规专员组成的申报团队,确保对技术特性和法规要求的全面理解,资料撰写是申报的核心环节,需按照监管部门要求的格式和内容,提交完整的技术文档,包括产品名称、型号规格、技术原理、预期用途、研发背景、创新点说明、产品性能研究、生物相容性评价、临床评价(临床试验或同品种比对)、风险分析、生产工艺、说明书、标签样稿等,临床评价是重中之重,对于正畸新技术,需提供充分的临床数据证明其在矫治效果、安全性(如牙根吸收、黏膜损伤等)、患者舒适度等方面优于或等同于现有技术,数据来源需真实、可靠,临床试验需符合《医疗器械临床试验质量管理规范》(GCP)要求,通过伦理审查并严格实施,提交受理后,监管部门将对资料进行形式审查,符合要求的予以受理并进入技术审评阶段;审评过程中,专家会对技术文档、临床数据、风险控制措施等进行全面评估,可能要求申报单位补充资料或进行现场核查,审评通过后进入行政审批阶段,最终由监管部门决定是否批准注册或准入,获批准后技术方可上市应用,并纳入后续的上市后监管体系,包括不良事件监测、定期质量跟踪等。
在申报材料准备中,正畸新技术的创新性阐述和临床数据支撑尤为关键,创新性需具体说明与现有技术的区别,如材料成分的改进(如新型高分子矫治材料的弹性模量提升)、结构设计的优化(如自锁托槽的摩擦力降低机制)、数字化技术的融合(如AI辅助矫治方案设计系统)等,需提供对比数据和实验结果佐证,临床数据方面,对于创新性较高的技术,通常需开展多中心、随机对照临床试验,样本量需满足统计学要求,评价指标应涵盖客观指标(如牙移动精度、矫治时间、X线片显示的牙根长度变化等)和主观指标(如患者疼痛评分、美观满意度、佩戴依从性等),同时需详细说明试验设计、入组标准、排除标准、统计方法及结果分析,确保数据的科学性和说服力,风险分析报告需全面识别技术可能存在的风险(如材料毒性、操作不当导致的并发症、设备故障等),并制定相应的风险控制措施,如操作培训、患者知情同意、设备维护计划等,形成完整的风险管理文档。
正畸新技术申报过程中,申报单位常面临资料准备复杂、审评标准把握不准、临床试验周期长等挑战,为提高申报成功率,建议申报单位尽早与监管部门沟通,明确技术分类和申报要求;组建跨学科团队,确保研发、临床、法规等各环节专业协同;严格遵循GCP开展临床试验,确保数据真实可靠;在资料撰写中突出技术优势,用数据和事实支撑创新性和有效性,避免空泛描述,可关注国家鼓励创新的政策导向,如创新医疗器械特别审批通道,对具有核心技术发明专利、临床价值显著的技术实行优先审评,缩短审批周期。
政策层面,近年来国家持续加大对医疗器械创新的支持力度,NMPA发布的《创新医疗器械特别审查程序》明确了对具有显著临床价值的创新技术的优先审批,而《“十四五”医药工业发展规划》也提出推动高端医疗器械创新发展,鼓励数字化、智能化诊疗技术的研发与应用,在正畸领域,随着隐形矫治、3D打印个性化托槽、数字化正畸导航等技术的兴起,政策红利为新技术申报提供了有利环境,但同时也对技术的创新性和临床证据提出了更高要求,申报单位需在技术研发阶段即注重知识产权保护、数据积累和合规管理,为后续申报奠定坚实基础。
正畸新技术申报是连接科研创新与临床实践的桥梁,其规范性和严谨性直接关系到新技术能否安全、有效地服务于患者,申报单位需充分认识申报的重要性,严格遵循法规要求,系统准备申报材料,强化临床数据支撑,同时积极利用政策支持,推动技术创新与产业升级,随着监管体系的不断完善和行业技术的持续进步,正畸新技术申报将更加高效、透明,为口腔正畸领域的高质量发展注入动力。
相关问答FAQs
Q1:正畸新技术申报通常需要多长时间?
A:正畸新技术申报的时间因技术类型、申报路径及资料完整性而异,常规医疗器械注册申报通常需要12-18个月,若进入创新医疗器械特别审批通道,可缩短至6-12个月;诊疗技术准入审批时间因地方卫健委要求不同,一般为6-12个月,临床试验阶段耗时较长(通常为6-12个月),资料撰写和补充资料的时间也会影响整体进度,建议申报单位提前规划,确保临床试验和资料准备同步推进。
Q2:申报材料中最容易出错的环节是什么?如何避免?
A:临床评价和风险分析是申报材料中最易出错的环节,临床评价常见问题包括临床试验设计不合理(如对照组选择不当、样本量不足)、数据统计分析不规范、评价指标不全面等,易导致审评专家对有效性和安全性产生质疑,风险分析则常存在风险识别不全面(如忽略长期使用风险)、控制措施可操作性不足等问题,为避免此类错误,建议申报单位在临床试验阶段聘请专业临床研究设计团队,严格遵循GCP;在风险分析阶段采用系统化的风险管理工具(如FMEA故障模式与影响分析),邀请临床专家、工程师共同参与,确保风险识别全面、控制措施具体可行,并主动与监管部门沟通,及时获取审评反馈,优化申报材料。