正畸产品注册证是国家药品监督管理部门(如国家药品监督管理局,NMPA)批准的正畸类医疗器械合法上市凭证,其核心作用是证明产品符合国家标准、行业标准和技术要求,保障患者使用安全及治疗效果,正畸产品作为口腔医疗领域的重要器械,涵盖托槽、矫治器、弓丝、种植钉等多种类型,其注册证的获取是企业合法生产经营的前提,也是医疗机构和患者选择产品的关键依据。
正畸产品的分类与管理类别
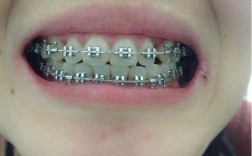
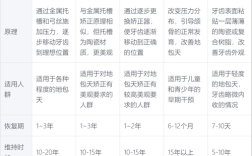
根据《医疗器械监督管理条例》及《医疗器械分类目录》,正畸产品通常按风险等级分为一类、二类和三类,一类风险最低,如正畸探针、托槽定位器等,实行备案管理;二类风险中等,如金属托槽、颊面管、矫治丝等,需取得注册证;三类风险较高,如隐形矫治器、自锁托槽等,涉及复杂材料与人体长期接触,需严格审评审批,不同类别的产品,注册流程、技术要求和审批周期差异显著,例如隐形矫治器因涉及个性化设计、材料生物相容性等,通常按第三类医疗器械管理,注册流程更为严格。

正畸产品注册证的重要性
法律合规性的核心体现
未取得注册证的正畸产品不得生产、销售和使用,根据《医疗器械注册与备案管理办法》,企业需通过注册流程提交产品技术要求、检验报告、临床评价资料等,证明产品安全有效,若企业无证生产或销售,将面临没收违法所得、罚款甚至吊销许可证等处罚,医疗机构使用无证产品也将承担法律责任。
患者安全与治疗效果的保障
正畸产品直接作用于口腔环境,需具备良好的生物相容性、机械性能和稳定性,注册证的获取需通过严格的生物学评价(如细胞毒性、致敏性测试)、机械性能测试(如托槽抗腐蚀性、弓丝弹性模量)和临床评价(如临床试验或同品种产品对比),确保产品在长期使用中不会引发不良反应,且能达到预期的矫治效果,隐形矫治器的材料需通过ISO 10993系列标准测试,避免对口腔黏膜造成刺激;矫治丝需具备持续的弹力性能,确保牙齿移动的精准性。
市场准入与品牌信任的基石
医疗机构在选择正畸产品时,优先考虑取得注册证的合规产品,这既是医疗安全的底线要求,也是建立患者信任的基础,注册证信息可通过国家药监局数据库查询,公开透明的资质信息有助于企业树立品牌形象,提升市场竞争力,随着“集采”政策的推进,具备注册证的正畸产品才能参与集中采购,进一步扩大市场份额。
正畸产品注册证的申请流程
正畸产品注册证的申请需遵循《医疗器械注册管理办法》的规定,主要流程包括产品分类界定、临床评价、注册检验、体系核查、技术审评和行政审批等环节,具体如下表所示:

| 步骤 | 关键要求 | |
|---|---|---|
| 产品分类界定 | 确定产品的管理类别(一类/二类/三类)和分类编码 | 向药监局提交产品描述、预期用途、技术参数等材料,明确是否需临床试验 |
| 临床评价 | 收集产品安全性、有效性证据 | 二类产品可提供同品种临床评价报告;三类产品通常需开展临床试验(需通过伦理审批) |
| 注册检验 | 由具备资质的检验机构对产品进行全项目检验 | 检验依据产品技术要求和相关国家标准(如YY 0065《口腔正畸托槽》) |
| 质量管理体系核查 | 检查企业生产质量管理体系是否符合ISO 13485标准 | 核查生产场地、设备、人员、文件记录等,确保生产过程可控 |
| 技术审评 | 药监局对注册资料进行完整性、合规性审查 重点关注产品风险分析、临床评价结论、说明书和标签等 | |
| 行政审批 | 审评通过后,药监局核发《医疗器械注册证》(有效期5年,可申请延期) | 注册证需载明产品名称、型号规格、生产企业、注册证编号等信息 |
注册证的关键要求与技术考量
技术文件的完整性
注册申请需提交详细的技术文件,包括产品结构图、原材料清单、生产工艺流程、检验方法、产品标准等,金属托槽需明确材质(如不锈钢)、尺寸规格(如托槽槽沟深度0.022英寸)、表面处理工艺(如电解抛光)等;隐形矫治器还需提交三维设计软件的验证报告,确保矫治方案的精准性。
生物相容性与安全性
正畸产品长期接触口腔黏膜、唾液和牙龈组织,需通过ISO 10993-1《生物学评价》系列测试,包括细胞毒性、致敏性、遗传毒性等,隐形矫治器的常用材料(如PETG、TPU)需提供ISO 10993-5细胞毒性试验合格报告,确保无细胞毒性风险。
临床评价的科学性
临床评价是注册证的核心环节,需证明产品的临床价值,对于二类产品,可通过同品种产品对比(如与已上市托槽的矫治效率、安全性数据对比);三类产品(如隐形矫治器)通常需开展多中心临床试验,纳入受试者100例以上,收集牙齿移动数据、不良反应发生率等,验证其有效性和安全性。
注册证的持续监管与变更管理
取得注册证并非一劳永逸,企业需接受药监局的持续监管,包括生产环节的飞行检查、上市后不良事件监测、产品抽检等,若产品发生重大变更(如原材料替换、生产工艺变更、适用范围扩大),需申请注册证变更或重新注册,某企业将托槽的材质从不锈钢改为钛合金,需提交变更后的生物相容性数据和技术文件,经审评批准后方可更新注册证。
注册证到期前6个月,企业需提出延续注册申请,提交生产质量管理体系运行报告、产品跟踪评价报告等,证明产品仍符合安全有效要求,方可延续注册证有效期。
正畸产品注册证的市场影响
随着口腔健康意识的提升,正畸市场需求持续增长,注册证的合规门槛加速了行业整合,具备技术优势和注册证的企业更容易通过医院招标和集采,而中小企业因无法满足注册要求逐渐退出市场,在隐形矫治领域,时代天使、隐适美等头部企业均拥有多项三类注册证,通过临床数据积累和品牌建设占据主导地位。
对消费者而言,注册证是选择正畸产品的重要参考,患者在购买隐形矫治器、托槽等产品时,可通过“国家药监局官网”查询注册证信息,避免使用无证产品带来的健康风险。
相关问答FAQs
Q1:正畸产品注册证的有效期是多久?到期后如何延续?
A:正畸产品注册证的有效期为5年,企业需在注册证有效期届满前6个月,向原审批部门提出延续注册申请,延续注册需提交以下材料:(1)医疗器械注册证延续申请表;(2)产品注册证复印件;(3)产品技术要求复印件;(4)连续3个季度生产质量管理体系运行报告;(5)产品上市后跟踪评价报告,包括不良事件监测、产品召回等情况;(6)证明产品安全有效的其他资料,药监局将对申请资料进行技术审评,符合要求的准予延续,注册证有效期延长5年;若产品存在安全隐患或未满足法定要求,将不予延续。
Q2:申请正畸产品注册证需要多长时间?哪些因素会影响审批周期?
A:正畸产品注册证的审批周期因产品管理类别而异,一类医疗器械备案,企业提交资料后,药监局将在5个工作日内完成形式审查,符合要求的予以备案,流程较快;二类医疗器械注册,技术审评时间为60个工作日,体系核查与审评并行,总计约4-6个月;三类医疗器械注册(如隐形矫治器),技术审评时间为90个工作日,且通常需开展临床试验,审批周期可能长达1-2年,影响审批周期的因素包括:(1)资料完整性:若技术文件、临床数据存在缺项,需补正资料,延长审评时间;(2)临床试验进度:三类产品的临床试验需受试者入组、数据收集,周期较长;(3)审评沟通:若企业需与审评中心就技术问题多次沟通,也会延长审批周期。