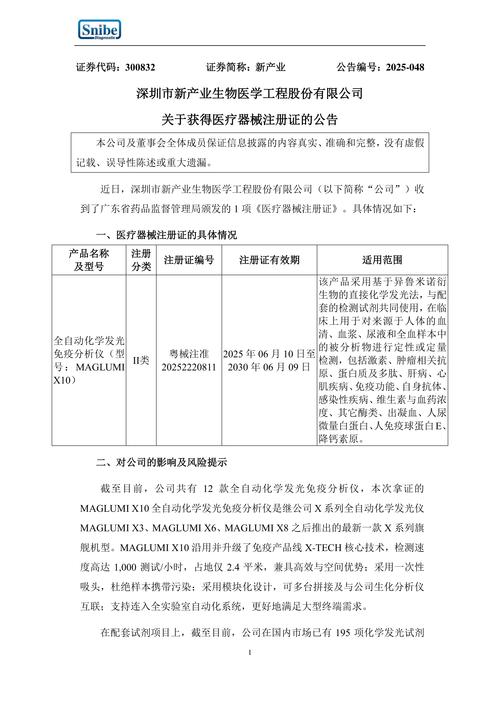
正畸软件作为医疗器械进行注册,需要遵循严格的法规要求,以确保其安全性、有效性和合规性,以下是针对中国(NMPA)、美国(FDA)和欧盟(MDR)等主要市场的注册流程和关键要点:
核心概念:正畸软件的医疗器械属性
正畸软件通常用于:
- 3D牙颌模型分析与测量
- 矫治方案设计与模拟
- 矫治器数字化设计与制造
- 患者数据管理
- 关键判定:若软件用于诊断、治疗计划制定或直接控制医疗设备(如3D打印机),则属于医疗器械。
中国(NMPA)注册流程
分类界定
- 分类依据:《医疗器械分类目录》
- II类:如正畸影像分析软件(非诊断用途)、患者管理软件。
- III类:如用于制定治疗计划、模拟矫治效果的AI软件,或直接控制3D打印机的软件。
- 途径:向器审中心提交分类界定申请。
注册资料准备
- 技术文档:
- 软件描述(功能、算法、架构)
- 风险管理报告(ISO 14971)
- 临床评价报告(需提供真实世界数据或临床试验)
- 软件验证与确认报告(功能、性能、安全性测试)
- 数据安全与隐私保护方案
- 临床评价:
- 若无同类产品,需提供临床试验(如多中心研究)。
- 可采用同品种比对(需证明等同性)。
- 网络安全:符合《医疗器械网络安全审查指导原则》。
注册路径
- II类:办理备案(境内)或注册(进口)。
- III类:必须申请注册(境内/进口)。
- 流程:提交申请 → 技术审评(6-10个月) → 体系核查(生产/经营) → 发证。
生产质量管理
- 需通过《医疗器械生产质量管理规范》(GMP)检查。
美国(FDA)注册流程
分类与途径
- 软件分类:
- SaMD(独立软件):如治疗计划软件 → 通常为II类。
- SiMD(医疗器械附件):如控制3D打印机的软件 → 依主设备分类。
- 注册途径:
- 510(k) clearance:证明与已上市产品实质等同(适用于II类)。
- De Novo:无同类产品时,重新定义分类(风险较低)。
- PMA:高风险III类软件(如AI辅助诊断)。
关键要求
- 21 CFR Part 820:质量体系规范(QSR)。
- 21 CFR Part 11:电子记录/电子签名合规。
- 临床证据:需提供临床数据或文献支持有效性。
- 网络安全:符合《医疗设备网络安全指南》。
流程
- 提交申请 → FDA审评(510(k)约6个月) → 发放许可(510(k) Number)。
欧盟(MDR)注册流程
分类与途径
- 软件分类:
- IIa类:患者管理软件。
- IIb类:治疗计划软件、AI辅助决策软件。
- III类:高风险诊断/治疗软件(极少见)。
- 注册路径:
- 需指定欧盟授权代表(EC REP)和公告机构(Notified Body)。
- IIa类:自我符合性声明(无需NB审核)。
- IIb/III类:需通过NB审核(CE Mark)。
关键要求
- 技术文件:
- 风险管理(ISO 14971)
- 临床评价(需包含PMS数据)
- 软件生命周期管理(ISO 62304)
- 数据保护(GDPR合规)
- 临床评估:需提供临床调查报告或文献综述。
流程
- 技术文件准备 → NB审核(6-12个月) → CE认证 → EUDAMED数据库注册。
全球注册共通要点
- 软件生命周期管理:
- 遵循ISO 62304(医疗器械软件生命周期过程)。
- 需建立变更控制流程(如算法更新、功能扩展)。
- 数据安全与隐私:
符合GDPR(欧盟)、HIPAA(美国)、中国《个人信息保护法》。
- 临床证据:
真实世界数据(RWD)或临床试验是核心依据。
- 语言与本地化:
注册文件需目标市场官方语言(如欧盟需英文)。
注册周期与成本
| 地区 | 注册类型 | 周期 | 成费(约) |
|---|---|---|---|
| 中国 | III类注册 | 1-2年 | 50万-150万人民币 |
| 美国 | 510(k) | 6-12个月 | 10万-30万美元 |
| 欧盟 | IIb类 CE | 12-24个月 | 15万-50万欧元 |
建议行动步骤
- 明确软件功能:确定是否为医疗器械及风险等级。
- 选择目标市场:优先注册核心市场(如中国+欧盟/美国)。
- 组建专业团队:法规、临床、软件工程人员协作。
- 启动临床评价:尽早收集数据(文献、试验、RWD)。
- 委托CRO:利用专业机构加速流程(如NMPA/FDA/MDR专家)。
注意:各国法规动态更新(如欧盟MDR过渡期延长),需持续跟踪最新要求,建议在注册前咨询当地法规专家,避免因合规问题延误上市。
(图片来源网络,侵删)
通过系统化准备和合规管理,正畸软件可高效完成全球注册,顺利进入临床应用。